Entregas 24/48 H (días hábiles)
Envios GRATIS desde 29.95 € (compra)
Debido al apagón, los pedidos realizados del día 25 al 28 de abril saldrán todos a partir del día 29 de abril
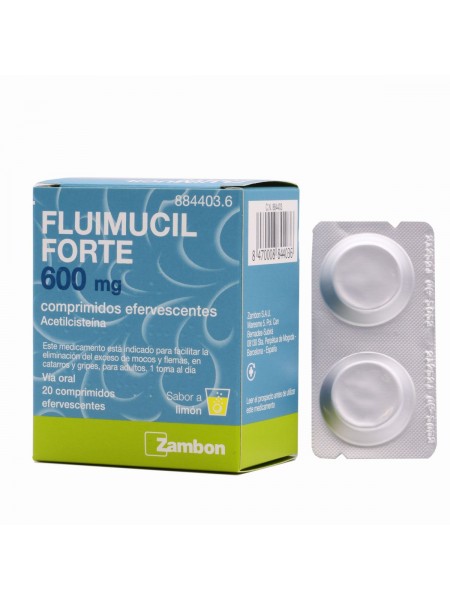
FLUIMUCIL FORTE 600 MG 20 COMPRIMIDOS EFERVESCENTES
Fluimicil 600 mg es un tratamiento para reducir la viscosidad de las secreciones mucosas, facilitando su expulsión, en procesos catarrales y
gripales, para adultos y adolescentes a partir de 12 años.
¿Tienes dudas? te ayudamos en el 976 73 46 08
ENVÍOS 4.95€ --- GRATIS a partir de 29.95 € (compra)
Entregas 24/48 H (días hábiles)
Pago 100% seguro - Métodos de pago: 
Fluimicil 600 mg es un tratamiento para reducir la viscosidad de las secreciones mucosas, facilitando su expulsión, en procesos catarrales y
gripales, para adultos y adolescentes a partir de 12 años.
1. NOMBRE DEL MEDICAMENTO
Fluimucil Forte 600 mg comprimidos efervescentes
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido efervescente contiene:
Acetilcisteína
Excipientes con efecto conocido
Aspartamo (E951)
Sodio
Sulfitos (contenidos en el aroma)
Glucosa (contenida en el aroma)
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimidos redondos, planos y de color blanco.
4. DATOS CLÍNICOS
4.1. Indicaciones terapéuticas
Reducción de la viscosidad de las secreciones mucosas, facilitando su expulsión, en procesos
catarrales y gripales para adultos.
4.2. Posología y forma de administración
Adultos:
600 mg de acetilcisteína (1 comprimido efervescente) en una sola toma. No superar la dosis de 600 mg al
día
Niños y adolescentes:
Los niños y adolescentes no pueden tomar este medicamento.
Hay otras presentaciones más adecuadas para esta población
Forma de administración:
Por vía oral. En dosis única por la mañana, según la posología prescrita.
Disolver 1 comprimido efervescente en un vaso de agua. La solución obtenida se toma directamente del
vaso.
Se recomienda beber un vaso de agua o cualquier otro líquido después de cada dosis abundante cantidad de
líquido durante el día.
Este medicamento se puede tomar con o sin comida. La toma concomitante del medicamento con comida
no afecta a la eficacia del mismo.
Si el paciente no mejora o empeora después de 5 días de tratamiento, se debe evaluar la situación clínica.
4.3. Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
No administrar a niños menores de 2 años.
4.4. Advertencias y precauciones especiales de empleo
Los agentes mucolíticos pueden inducir obstrucción respiratoria en niños menores de 2 años. Debido a las
características fisiológicas de las vías respiratorias en este grupo de edad, la capacidad de expectoración
puede verse limitada. Por consiguiente, los agentes mucolíticos no se deben utilizar en niños menores de 2
años (ver 4.3 Contraindicaciones).
Se recomienda precaución en la utilización del producto en pacientes con úlcera péptica o antecedentes de
úlcera péptica, en especial en caso de administración concomitante con otros medicamentos con efecto
conocido de irritación de la mucosa gástrica. Si se observa la aparición de molestias gástricas, se debe
reevaluar la situación clínica.
Se evaluará la administración del medicamento en pacientes asmáticos, con antecedentes de
broncoespasmo o con otra insuficiencia respiratoria grave, ya que puede aumentar la obstrucción de las
vías respiratorias o inducir broncoespasmo, especialmente si se administra por vía inhalatoria.
Si se produjera broncoespasmo se interrumpirá la administración de acetilcisteína y se instaurará el
tratamiento adecuado.
La administración de acetilcisteína, principalmente al inicio del tratamiento, podría fluidificar la secreción
bronquial y dar lugar a un aumento de la expectoración. Si el paciente no es capaz de expectorar de forma
efectiva, debe llevarse a cabo un drenaje postural y broncoaspiración.
Acetilcisteína puede afectar el metabolismo histamínico de forma moderada, por consiguiente se debe
administrar con precaución en el tratamiento de larga duración en pacientes con intolerancia histamínica,
puesto que se pueden producir síntomas de intolerancia (cefalea, rinitis vasomotora, prurito).
La eventual presencia de un leve olor sulfúreo no indica la alteración del preparado, sino que es propia del
principio activo.
Si después de 5 días no se presenta mejoría o aparecen otros síntomas, se debe reevaluar la situación
clínica.
Información sobre excipientes
Este medicamento contiene 20 mg de aspartamo en cada comprimido.
El aspartamo contiene una fuente de fenilalanina que puede ser perjudicial en caso de padecer
fenilcetonuria (FCN).
No hay datos clínicos o preclínicos disponibles que permitan evaluar el uso de aspartamo en lactantes por
debajo de 12 semanas de edad.
Este medicamento contiene 157,9 mg de sodio por comprimido equivalente a 7,9 % de la ingesta máxima
diaria de 2 g de sodio recomendada por la OMS para un adulto.
Este medicamento contiene glucosa. Los pacientes con problemas de absorción de glucosa o galactosa no
deben tomar este medicamento.
Este medicamento puede producir reacciones alérgicas graves y broncoespasmo porque contiene sulfitos.
4.5. Interacción con otros medicamentos y otras formas de interacción
Antitusivos. Dado que los antitusivos provocan la inhibición del reflejo de la tos, no se recomienda la
administración de acetilcisteína con estos fármacos o con sustancias inhibidoras de las secreciones
bronquiales (anticolinérgicos, antihistamínicos….), ya que se puede dificultar la eliminación de las
secreciones.
Sales de metales. Debido a su posible efecto quelante, debe tenerse en cuenta que la acetilcisteína puede
reducir la biodisponibilidad de las sales de algunos metales como el oro, calcio, hierro. En este caso se
recomienda espaciar las tomas al menos 2 horas.
No se recomienda la disolución de formulaciones de acetilcisteína de forma concomitante con otros
medicamentos.
Antibióticos. Si se administra acetilcisteína junto con antibióticos como amfotericina B, ampicilina sódica,
cefalosporinas, lactobionato de eritromicina o algunas tetraciclinas, pueden ser físicamente incompatibles o
incluso pueden resultar inactivados los antibióticos. En estos casos, se recomienda separar las tomas al
menos un intervalo de 2 horas. Esto no se refiere a loracarbef.
Se ha demostrado que la administración simultánea de nitroglicerina y acetilcisteína produce una
hipotensión significativa e incremento de la dilatación de la arteria temporal. Si es necesario la terapia
conjunta de nitroglicerina y acetilcisteína, los pacientes deben ser controlados por la aparición de
hipotensión, que puede ser grave, y advertir a los pacientes sobre la posibilidad de cefaleas.
El uso concomitante de acetilcisteína y carbamazepina puede dar lugar a niveles subterapéuticos de
carbamazepina.
Población pediátrica
Los estudios de interacciones se han realizado sólo en adultos.
Interferencias con pruebas analíticas
La acetilcisteína puede interferir con el método de valoración colorimétrica para la determinación de
salicilatos.
La acetilcisteína puede interferir con el ensayo de cetonas en orina.
4.6. Fertilidad, embarazo y lactancia
Embarazo
Los datos clínicos relativos al uso de acetilcisteína en mujeres embarazadas, son limitados. Los estudios en
animales no han mostrado efectos directos o indirectos indicativos de toxicidad reproductiva (ver sección
5.3).
Como medida de precaución es preferible evitar el uso de Fluimucil durante el embarazo.
Antes de utilizar el medicamento en el embarazo se debe realizar una valoración de los riesgos frente a los
beneficios potenciales. Se recomienda la administración de acetilcisteína bajo supervisión médica durante
el embarazo.
Lactancia
Se desconoce si acetilcisteína o sus metabolitos se excretan en la leche materna.
No se puede excluir un riesgo para el lactante.
Se deberá decidir entre interrumpir la lactancia o interrumpir o abstenerse del tratamiento con Fluimucil,
tras considerar el beneficio de la lactancia para el lactante y el beneficio del tratamiento para la madre. Se
recomienda su administración bajo supervisión médica durante la lactancia.
Fertilidad
Se desconoce el potencial efecto de la acetilcisteína sobre la fertilidad. Los estudios en animales no indican
efectos perjudiciales con respecto a la fertilidad en humanos a las dosis recomendadas (ver sección 5.3).
4.7. Efectos sobre la capacidad para conducir y utilizar máquinas
No existe evidencia de efectos sobre la capacidad para conducir y utilizar máquinas.
4.8. Reacciones adversas
Las reacciones adversas más frecuentes asociadas con la administración oral de acetilcisteína son de
naturaleza gastrointestinal. Con menor frecuencia se han notificado reacciones de hipersensibilidad
incluido shock anafiláctico, reacciones anafilácticas/anafilactoides, broncoespasmo, angioedema, erupción
cutánea y prurito.
Al igual que todos los medicamentos, Fluimucil puede producir efectos adversos, aunque no todas las personas los sufran.
Se pueden producir los siguientes efectos adversos:
- Poco frecuentes (pueden afectar hasta 1 de cada 100 pacientes): hipersensibilidad, dolor de cabeza, zumbido de oídos, taquicardia, vómitos, diarrea, estomatitis, dolor abdominal, náuseas, urticaria, erupción cutánea, angioedema, prurito, aumento de la temperatura corporal, hipotensión.
- Raros (pueden afectar hasta 1 de cada 1.000 pacientes): somnolencia, broncoespasmo, dificultad respiratoria, molestias digestivas.Muy raros (pueden afectar hasta 1 de cada 10.000 pacientes): reacciones alérgicas, shock anafiláctico, hemorragia, reacciones cutáneas graves como síndrome de Stevens-Johnson y síndrome de Lyell, en ocasiones identificadas con al menos la toma de otro fármaco de forma simultánea.
- Frecuencia no conocida (no puede estimarse a partir de los datos disponibles): hinchazón de la cara.
En caso de producirse cualquier alteración en la piel o membranas mucosas, debe interrumpirse inmediatamente la administración de acetilcisteína y solicitar asistencia médica.
Comunicación de efectos adversos:
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
En casos muy raros, se ha descrito la aparición de reacciones cutáneas graves tales como síndrome de
Stevens-Johnson y síndrome de Lyell en conexión temporal con la administración de acetilcisteína. En la
mayoría de los casos se pudo identificar también al menos otro fármaco sospechoso de desencadenar el
síndrome mucocutáneo.
En caso de producirse cualquier alteración en la piel o membranas mucosas, debe interrumpirse
inmediatamente la administración de acetilcisteína y solicitar asistencia médica.
Varios estudios han confirmado una reducción en la agregación plaquetaria en presencia de acetilcisteína,
aunque aún no está confirmada la significación clínica de dicho efecto.
Notificación de sospechas de reacciones adversas:
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello
permite una supervisión continuada de la relación beneficio / riesgo del medicamento. Se invita a los
profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de
Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaRAM.es.
4.9. Sobredosis
En caso de ingestión masiva, se puede producir una intensificación de los efectos adversos,
fundamentalmente de tipo gastrointestinal como náuseas, vómitos y diarrea.
No existe antídoto específico para acetilcisteína por lo que se recomienda aplicar tratamiento sintomático.
Se mantendrán las vías respiratorias libres de secreciones, recostando al paciente y practicando aspiración
bronquial. Si se estima necesario, se realizará un lavado gástrico (si no han transcurrido más de 30 minutos
después de la ingestión).
Voluntarios sanos recibieron 11,2 g acetilcisteína al día durante tres meses, sin efectos adversos graves.
Dosis orales de hasta 500 mg de acetilcisteína / kg peso corporal fueron toleradas sin ningún síntoma de
intoxicación.
5. PROPIEDADES FARMACOLÓGICAS
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: Mucolíticos.
Código ATC: R05CB01. Acetilcisteína
Mecanismo de acción y efectos farmacodinámicos
La acetilcisteína es un agente mucolítico que disminuye la viscosidad de las secreciones mucosas,
fluidificando el moco sin aumentar su volumen, a la vez que activa el epitelio ciliado, con lo que favorece
la expectoración y la normalización de la función mucociliar.
Su efecto mucolítico se explica por la despolimerización de los complejos mucoproteico y ácidos
nucleicos, que aumentan la viscosidad al componente vítreo y purulento del esputo y otras secreciones,
efecto que lleva a cabo su grupo sulfhidrilo libre, que actúa directamente sobre las mucoproteínas
rompiendo los puentes disulfuro y disminuyendo la viscosidad del moco.
La acetilcisteína también ejerce una acción antioxidante directa a través del mismo grupo sulfhidrilo libre (SH), que actúa directamente sobre los grupos electrofílicos de los radicales oxidantes.
Por su carácter reductor, la acetilcisteína ejerce una actividad citoprotectora en el aparato respìratorio frente
a la acción lesiva del estrés oxidativo por radicales libres oxidantes de diversa etiología a nivel pulmonar.
En base a su estructura derivada de la cisteína, la acetilcisteína actúa como precursor en la síntesis de
glutatión y normaliza sus niveles cuando éstos se reducen por una agresión oxidante continuada sobre el
aparato respiratorio.
Otras propiedades adicionales son la reducción de la hiperplasia inducida de células mucosas y el aumento
de la producción de surfactante por estimulación de los neumocitos tipo II.
La acetilcisteína protege a la α1-antitripsina, una enzima inhibidor de la elastasa, de la inactivación por el
ácido hipocloroso (HOCl), un potente agente oxidante producido por la enzima mieloperoxidasa de los
fagocitos activados.
Además, su estructura molecular permite a la acetilcisteína atravesar fácilmente las membranas celulares.
En el interior de la célula, la acetilcisteína es desacetilada, produciendo así L-cisteína, aminoácido
indispensable para la síntesis del glutation (GSH). La acetilcisteína ejerce además un efecto antioxidante
indirecto a través de su papel como precursor GSH. El GSH es un tripéptido extremamente reactivo que se
encuentra difundido en los diversos tejidos de los organismos animales y es esencial para mantener la
capacidad funcional y la integridad de la morfología celular. De hecho, es el mecanismo más importante de
defensa intracelular contra los radicales oxidantes, tanto exógenos como endógenos, y contra diversas
substancias citotóxicas, incluido el paracetamol.
La acetilcisteína ejerce su papel de importancia fundamental en el mantenimiento de los niveles apropiados
de GSH, contribuyendo así a la protección celular. Por lo tanto, la acetilcisteína representa un antídoto
específico para la intoxicación por paracetamol.
Eficacia clínica y seguridad
El efecto mucolítico de la acetilcisteína ha sido demostrado clínicamente en varios ensayos clínicos
controlados por placebo.
5.2. Propiedades farmacocinéticas
Absorción
La acetilcisteína se absorbe completamente tras administración oral. Debido a a una metabolización en la
pared intestinal y al efecto de primer paso hepático, la biodisponibilidad de acetilcisteína por vía oral es
escasa (aprox. 10%). En pacientes con diversas enfermedades respiratorias o cardíacas, la concentración
máxima plasmática se obtiene entre dos y tres horas tras su administración, y los niveles permanecen altos
durante un periodo de 24 h.
Distribución
La acetilcisteína se distribuye en la forma no metabolizada (20%) y metabolizada (activa) (80%), y puede
encontrarse principalmente en el hígado, riñones, pulmones y secreciones bronquiales.
El volumen de distribución de la acetilcisteína varía de 0,33 a 0,47 l/kg. La fijación a proteínas plasmáticas
es escasa, aproximadamente del 50% a las 4 horas de la dosis y disminuye hasta el 20% a las 12 h.
Biotransformación
La acetilcisteína sufre un extenso metabolismo rápido en la pared intestinal e hígado tras su administración
oral. El compuesto que resulta, cisteína, es considerado un metabolito activo. Después de esta etapa de
transformación, la acetilcisteína y la cisteína comparten la misma ruta metabólica.
Eliminación
El aclaramiento renal puede alcanzar alrededor del 30% del aclaramiento corporal total. La semivida
teminal de la acetilcisteína total tras la administración oral es de 625 (4,59 - 10,6) h.
Linelidad / no linealidad
La farmacocinética de la acetilcisteína es proporcional a la dosis administrada en el rango de dosis entre
200-3200 mg/m2 para AUC y Cmax.
5.3. Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los
estudios convencionales de toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico,
toxicidad para la reproducción y el desarrollo.
6 . DATOS FARMACÉUTICOS
6.1. Lista de excipientes
aspartamo (E951),
hidrogenocarbonato de sodio,
ácido cítrico anhidro (E330),
aroma de limón (contiene glucosa y sulfitos).
6.2. Incompatibilidades
La acetilcisteína reacciona con ciertos metales, especialmente con hierro, níquel y cobre, así como con el
caucho. Se debe evitar el contacto con materiales que los contengan.
Si se mezclan soluciones de acetilcisteína con antibióticos como amfotericina B, ampicilina sódica,
cefalosporinas, lactobionato de eritromicina o algunas tetraciclinas, pueden ser físicamente incompatibles o
incluso pueden resultar inactivados los antibióticos. En estos casos, se recomienda separar las tomas al
menos un intervalo de 2 horas.
No se recomienda la disolución de formulaciones de acetilcisteína de forma concomitante con otros
medicamentos.
6.3. Periodo de validez
3 años.
6.4. Precauciones especiales de conservación
No requiere condiciones especiales de conservación
6.5. Naturaleza y contenido del envase
Envase con 10 ó 20 comprimidos efervescentes en blisters de aluminio/polietileno y
poliamida/aluminio/polietileno.
6.6. Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él,
se realizará de acuerdo con la normativa local, o se procederá a su devolución en la farmacia.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Zambon S.A.U.
C/ Maresme, 5. Polígono Can Bernades-Subirà
08130-Sta. Perpètua de Mogoda (Barcelona)
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
62663
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: Julio 1999
Fecha de la última renovación: Julio 2009
10. FECHA DE LA REVISIÓN DEL TEXTO
Noviembre 2021
La información detallada de este medicamento está disponible en la página web de la Agencia Española
de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es.
Resolvemos tus dudas
Sobre este producto o cualquier otro, no dudes en ponerte en contacto con nuestros farmacéuticos y farmacéuticas de Farmacia Senante Actur, Zaragoza.
¡Consúltanos!